- Hot Line:
+(86)15801695345 - E-mail:
nar@china-reach.net

背景
中国国家市場監督管理総局は、旧衛生部などが過去に異なる時期に認可した「有効期限なし、製品技術要件なし」(以下「ダブルなし」)の健康食品の登録証を標準化し、登録情報を改善し、規制基準を統一するため、2023年8月31日付で「健康食品で謳うことのできる健康機能の目録 非栄養素サプリメント(2023年版)」とその付属文書を公布した。すでに健康機能目録に掲載されているが、機能表示が古い健康機能用語については、登録申請者は新旧の健康機能表示の連携と最新の評価要件に基づき、機能表示を変換する必要がある。公告が発表されてから5年以内に、証書の交換を完了する。2024年10月30日、国家市場監督管理総局は「生産・販売される「賞味期限なし、製品技術要件なし」の健康食品の集中交換証審査ポイント」を発表し、「ダブル無交換証」の健康食品の転換作業が正式に開始されることを示唆した。
政策と規則
1)「健康食品で謳うことのできる健康機能の目録 非栄養素サプリメント(2023年版)」
2)「生産・販売される「賞味期限なし、製品技術要件なし」の健康食品の集中交換証審査ポイント」
3)「保健食品人の試食試験倫理審査業務ガイドライン(2023年版)」
4)「保健食品機能検査と評価技術指導原則(2023年版)」
5)「保健食品機能検査と評価方法(2023年版)」
6)「保健食品及びその原料安全性毒理学的検査と評価技術指導原則(2020年版)」
どのようなダブルなし製品について機能性試験をやり直す必要があるのか?
1)元の機能性試験報告書の評価要件・基準は「健康食品の機能性評価手順及び試験方法(1996年版)」です。
2)以下の保健機能が含まれる。
| 番号 | 現在の健康機能 | 元の健康機能 | 再実行する機能テスト項目 |
| 1 | 免疫力を高める | 免疫調節、免疫強化 | 動物機能試験の再テスト |
| 2 | 抗酸化作用 | 老化遅延、抗酸化作用 | 人体食試験のやり直し |
| 3 | 記憶力向上 | 記憶力向上、記憶補助 | ウェクスラー記憶スケールを使用する場合、ヒト食品試験をやり直す |
| 4 | 肉体疲労の回復 | 疲労回復, 疲労回復 | 運動負荷試験がポールクライミングのみの場合は、動物機能試験をやり直す |
| 5 | 低酸素耐性 | 低酸素耐性、低酸素耐性の改善 | 動物機能試験をやり直す |
| 6 | 体脂肪のコントロールを助ける | 体重減少 | 機能検査の再実行 |
| 7 | 健康な血中脂質(コレステロール/トリグリセリド)レベルの維持を助ける | 血中脂質の調整(総コレステロール低下、トリグリセリド低下)、血中脂質の低下補助 | ヒト食餌試験をやり直す |
| 8 | 電離放射線からの保護 | 抗放射線、放射線障害に対する補助的防護 | 動物機能試験のやり直し |
ダブルなし交換証の登録変更のために提出する書類のリスト
1)保健食品登録申請表、及び申請者が申請材料の真実性に対して責任を負う法律責任承諾書
2)登録申請者本体の登録を証明する書類のコピー
2.1)登録申請者本体の登録を証明する書類のコピー
2.2)企業信用情報開示報告書
3)健康食品登録証明書及びその附属書のコピー
4)変更の具体的事項、理由及び根拠
5)上記の資料に加えて、「ダブルなし」製品の証書変更については、さらに適切な資料を提供する必要があります。
5.1全国範囲で製品の有効な生産ライセンス
5.2登録者は製品登録証明書に対して法律上の紛争と帰属上の争議が存在せず、及び証明書交換製品が法律執行事件の未処理状況に関連しない承諾書
5.3商品名変更申請書または商品名保持申請書、商標登録証のコピー(登録商標がない場合は不要)
5.4現行の要求に基づいて作成された製品技術要求及び作製改訂説明、研究材料、試験報告などの材料
5.5修正後の説明書のドラフトおよび改訂説明
5.6市販後食品安全報告書
5.7その他の備考
5.7.1また、製品生産許可発行部門が発行した製品の有効生産許可情報、及び実際に生産実行した製品配合、生産プロセス、製品技術要求の具体的な内容と確認意見を提供しなければならない
5.7.2製品の元の名称を保持する場合は、元の名称を保持する必要性の説明も必要
5.7.3保健機能の調整に関わる場合、「健康食品で謳うことのできる健康機能の目録 非栄養素サプリメント(2023年版)」の要求に基づき、対応する機能試験報告書を作成する必要がある
輸入健康食品は以下の資料も提出しなければならない:
6)製品の生産国(地域)の政府部門または法律サービス機関が発行した、登録申請者が掲載された健康食品の海外製造業者であることを証明する資格証明書類;
7)製品の生産国(地域)の政府部門または法律サービス機関が発行した、1年以上の健康食品販売の売上高、または製品の国外販売と群衆消費の安全性報告書;
8)中国に輸出された健康食品が中国の法規/基準に適合していることの説明、生産企業の品質管理システムが効果的に運行されていることの自己検査報告書;
9)製品が生産国(地域)で発売されている包装、ラベル、説明書のサンプル。
登録を変更する過程において、注意しなければならない事項は何か?
1)国内で生産された製品については、省市場監督部門は、製品の実際の生産、技術的な要件と監督および既存の法律や規制に基づいて、製品の変更意見を提出して、市場監督総局に報告し、登録者に連絡する。登録の変更を申請する前に、企業は事前に省局と良好なコミュニケーションを確立することをお勧めする;
2)登録変更する時、申請者は現行規定に基づいて、配合と原料・副原料の使用根拠を再確認しなければならない。もし配合が現行規定の要求を満たさない場合、配合を調整するか/および安全性・機能性評価情報をより多く提供する必要があるかもしれない;
3)登録変更する時、申請者は現行法規の要求に従い、製品表示指示と製品技術要求の内容を改善しなければならない;
4)製品の名称は、「健康食品の命名に関するガイドライン(2019年版)」およびその他の関連法規を遵守しなければならない。製品の原名の保留を申請する場合、理由は十分に合理的でなければならない;
5)必要に応じて、登録申請者は複数事項の登録申請を同時に変更申請することができる。
変更手続き
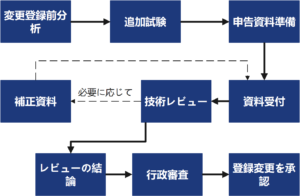
変更完了までの所要時間
最初の資料準備とサンプルテストから正式な審査まで、このような製品の登録変更のサイクルは1~3年を所要する。
サービス
健康食品の届出
健康食品登録申告
健康食品変更申告
健康食品登録の更新
健康食品技術移転

 中文
中文 English
English
