- Hot Line:
+(86)15801695345 - E-mail:
nar@china-reach.net

中国医療機器マスターファイル登録の詳細解説
中国医療機器マスターファイルは、その所有者が中国医療機器審査センターに提出し、医療機器の登録申請者が医療機器登録などの事項を申告する際に引用することを許可するために使用される。マスターファイルの登録は医療機器原材料、キープロセス、またはそれに関連する非臨床または臨床研究データなどの技術資料の提出と管理に関連する。
- 医療機器マスターファイル登録の規制根拠
- 国家薬監局の医療機器マスターファイル登録事項に関する公告
- 「医療機器登録管理弁法」
- 「体外診断試薬登録管理弁法」
- 「医療機器登録申告情報要求及び承認証明文書フォーマット」
- 「体外診断用試薬登録申告情報要件及び承認証明文書フォーマット」
- 「医療機器登録申請書の電子提出に関する技術指針」
- 応用分野の医療機器登録審査ガイドライン(例:ヒアルロン酸ナトリウムベースの顔面注射用フィラー登録技術審査ガイドライン)
- 医療機器マスターファイルの適用範囲
- 医療機器登録申請者が輸入2類、3類及び国内3類医療機器(体外診断試薬を含む)の登録、変更、臨床試験承認などの申請事項に引用するマスターファイル。
- 各省、自治区、直轄市薬品監督管理局は実際の状況に基づいて公告を参照して国内第2類医療機器のマスターファイル登録事項を行う。
- 医療機器マスターファイル登録の意義
- マスターファイル登録の自主原則かつ秘密保護原則に従って、マスターファイル所有者の知的財産権を保護する。
- 医療機器メーカーが原材料や主要部品を選択しやすくし、登録申告を簡素化するため。
- マスターファイルの内容には、医療機器に関連する原材料、添加物、成分、工程、または非臨床または臨床研究データに関する重要な情報が含まれることがあり、これは製品、特に高リスクで複雑な製品のリスク・ベネフィット比の体系的評価にとって極めて重要である。
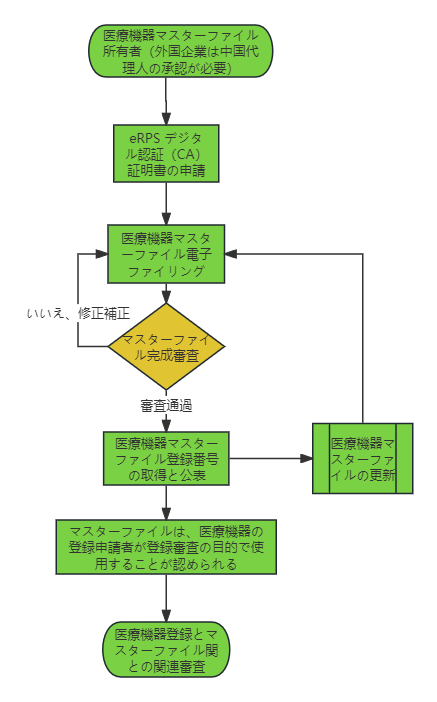
- 医療機器マスターファイル登録プロセス
マスターファイルの所有者は、医療機器評価センターの登録プラットフォームを通じて、必要に応じてマスターファイル登録情報を提出し、登録後にマスターファイル登録番号を取得することができ、マスターファイルは登録審査のために医療機器の登録申請者が使用することを許可され、審査機関は関連審査を実施する。
- 医療機器マスターファイル登録データリスト
| 項目 | 明細 | 説明 |
| 1.地域管理情報 | 1.1申請書 | データ・チェック・コード付きの申請書類 |
| 1.2アテステーションファイル | 企業資格認定文書 | |
| 1.3適合性/真正性の宣言 | 関連法規・規格への適合宣言、原材料の真正性宣言 | |
| 1.4その他の地域管理情報 | 中国における医療機器の登録証明書に関する情報、または中国国外における医療機器の販売を証明する書類等を提出 | |
| 2. 概要資料 | 機器と動作原理の包括的な説明 | マスターファイルの内容概要 |
| 3.非臨床試験に関する情報 | マスターファイルに登録するプロジェクト研究資料(プロジェクトに応じて適用項目を選択) | ①物理的・機械的性能 ②化学的/材料的特性評価 ③電気システム:安全性、機械的・環境的保護、電磁両立性 ④放射線安全性 ⑤生体適合性と毒性評価 ⑥生物由来材料(ヒト/動物)の安全性 ⑦エンドユーザー滅菌 ⑧洗浄・滅菌確認 ⑨再使用器具の再処理 ⑩動物試験 ⑪賞味期限と包装のバリデーション |
| 4.臨床評価情報 | 臨床評価情報 | 該当する場合は、臨床評価ガイドラインの関連情報を参照すること |
| 臨床試験情報 | 該当する場合は、臨床試験ガイドラインの関連情報を参照すること | |
| 5.品質管理システム手順 | 生産製造情報 | 受動医療機器: 原材料の製造と加工を明確にし、主要工程と特殊工程を示し、その工程管理点を記述する。 製造工程における様々な加工助剤の使用と不純物(残留モノマー、低分子残留物など)の管理を定義する。 |
| 能動医療機器: 重要部品の生産プロセスを明確にし、フローチャートの形式を採用し、そのプロセス制御点を説明する。 |
||
| 体外診断用医薬品: ①主原料の研究情報には、主反応成分、品質管理製品、校正製品などの選択と製造、それらの品質規格の研究情報、品質管理製品および校正製品の校正試験情報、校正製品のトレーサビリティ文書などが含まれる。 ②主な生産技術の研究資料は作業液の調製、分装と凍結乾燥、固相担体の被覆と組立、発色/発光システムなどの記述と確定根拠などを含む。 |
||
| 生産拠点 | 複数の開発・生産拠点があり、各開発・生産拠点の実態を概説する |
お問い合わせ先:
新安潤(北京)コンサルティング有限公司
担当者:尹(イン) 携帯電話:(+86)158-0169-5345(WeChat ID対応)
北京拠点:北京市朝陽区東三環北路甲26号 博瑞ビルA座4階 D10
電話: +86-10-64710683
上海拠点:上海市閔行区浦星公路 800 号 中意国際ビル D308 室
電話:+86-21-60537628
メール:nar@china-reach.net
サイト:https://www.china-reach.jp
過去のニュース
2013-2019 新安潤コンサルティング有限公司 Copyright2013-2019 All Right reserved 备案号 京ICP备12007213号-1
Service

 中文
中文 English
English
